Pour Pieter Boudrez Public Affairs Director de Medaxes «Il faut un plan national qui doit prévoir certains incitants et le remboursement spécifiques pour certaines pathologies afin de créer un marché pour les biosimilaires en Belgique.»
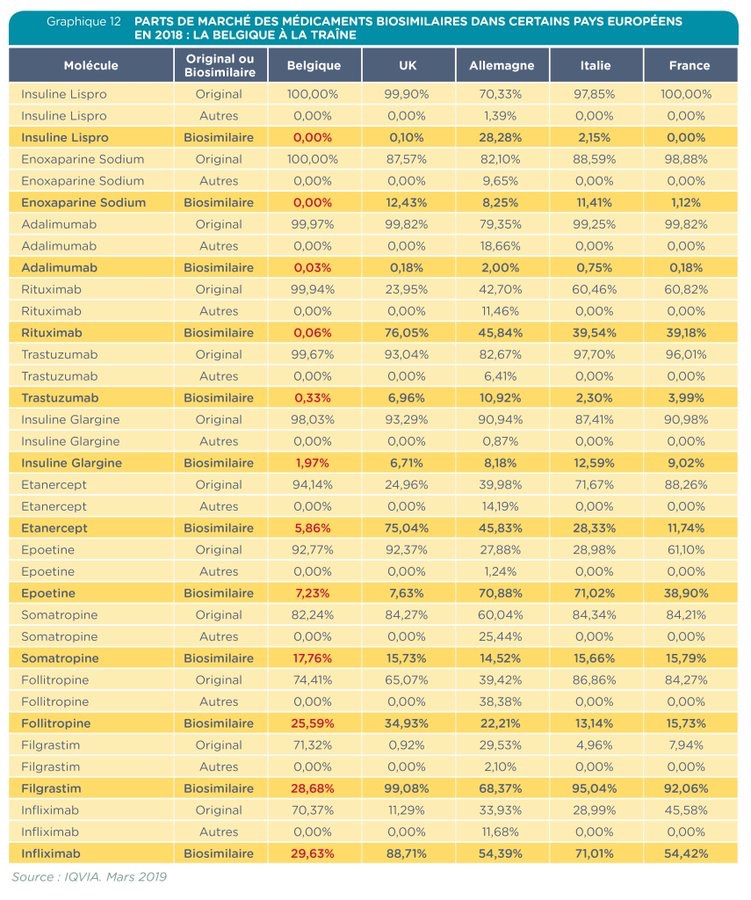
Aujourd’hui, comparé aux autres pays européens, l’utilisation des médicaments biosimilaires en Belgique est faible. «Les médecins ont confiance dans ces médicaments mais ne les prescrivent pas assez. A titre d’exemple, en France, l’objectif est d’atteindre les 80% pour 2021» explique Pieter Boudrez Public Affairs Director de Medaxes. Face à ces réticences, les entreprises du secteur s’interrogent: «est-il raisonnable de continuer à investir sur le marché belge? Aujourd’hui deux biosimilaires ne sont pas disponibles sur le marché belge parce que les sociétés constatent que les acteurs de soins de santé sont trop frileux.»
Une économie pour l’hôpital
Aujourd’hui, ces médicaments sont au moins 31% à 38% moins chers que le prix initial du médicament de marque. « Les médicaments biosimilaires permettent aujourd’hui à l’INAMI d’économiser 271 millions d’euros. » Un chiffre qui devrait croitre dans les prochains mois: «23 nouvelles molécules biosimilaires pourraient arriver sur le marché belge. En 2018, les versions originales de ces molécules ont réalisé un chiffre d’affaires de 448,2 millions.» ajoute Pieter Boudrez Public Affairs Director de Medaxes.
Malgré ces chiffres, les prescriptions ne décollent pas: «La stratégie des sociétés pharmaceutiques vendant des médicaments de marque nous fait mal. Par exemple, les marchés publics ne fonctionnent pas assez bien et il y a encore des contrats d’exclusivité pour quelques produits dans certains hôpitaux et ce n’est pas normal» remarque Pieter Boudrez Public Affairs Director de Medaxes. Il pointe du doigt certains hôpitaux: «Ils ne se rendent pas compte que les médicaments biosimiliaires permettent beaucoup d’économies pour le système des soins de santé mais que ceci n’est seulement possible qu’avec un volume substantiel.»
Sensibilisation de la ministre
Pour Medaxes, la procédure de prix et de remboursement doit pouvoir être lancée dès que le CHMP (Agence européenne des médicaments) donne un avis positif. «Il convient d’éliminer un certain nombre d’obstacles pratiques à l’accès au marché (par exemple, la distribution gratuite de médicaments originaux, les programmes spécifiques de «patient support», les programmes «medical needs», etc.).» Le rôle des pharmacies d’hôpitaux est essentiel dans ce changement de paradigme selon Pieter Boudrez: «Certaines rapportent près de 20% du budget de l’hôpital. Le choix de médicaments biosimiliares pourrait réduire la facture de plusieurs centaines de milliers d’euros.»
Maggie de Block entend faire bouger les lignes, selon lui: «Il faut un plan national qui doit prévoir des incitants en analysant les circonstances spécifiques pour certaines pathologies. Maggie de Block a déjà envoyé une lettre aux hôpitaux pour les sensibiliser à ces médicaments.»
Une prime pour le médecin
Outre les économies pour les hôpitaux qui pourraient être réinvesties dans les services, un incitant financier est prévu pour 2019. «Il s’agit d’une extra prime d’accréditation pour les gastroentérologues, les ophtalmologues, les rhumatologues, les endocrinologues... suivant qu’ils prescrivent 5-10-20% de biosimiliaires. Ils recevront la prime mi-2020.» Toutes les spécialités ne sont toutefois pas concernées : «Il s’agit d’un projet-pilote pour quelques spécialités. Actuellement, on remarque d’ailleurs que les oncologues et les hématologues sont plus réactifs à l’usage des biosimilaires....Comme on le constate par exemple au NHS en Angleterre.»
Comme Medaxes l’a expliqué dans son mémorandum «lorsque, pour une molécule donnée, une version biosimilaire arrive pour la première fois sur le marché, les hôpitaux devraient organiser dans les trois mois une procédure appropriée d’appel d’offres (marché public). La loi doit être adaptée dans ce sens.»
Un même remboursement
Un acte concret pourrait également être posé: «Les hôpitaux qui restent nettement sous la moyenne des prescriptions de biosimiliares devraient être invités à donner des explications et soumis à un suivi spécifique. Par ailleurs, afin d’éviter des distorsions de marché, l’original et le(s) biosimilaire(s) doivent être remboursés au même niveau par l’INAMI.»
Enfin, un autre atout apparaît important pour le Public Affairs Director de Medaxes, Pieter Boudrez: «Les budgets dégagés par la vente de médicaments biosimiliares vont permettre aussi d’utiliser des moyens pour de nouveaux médicaments et pour traiter plus de patients ou même d’intervenir plus tôt dans leur traitement. Il faut considérer les biosimilaires comme une opportunité unique pour chaque partie (médecins, patients, hopitaux, assurance de maladie,…) concernée dans le secteur»
On ne parle qu’en marque et jamais en molécules durant notre apprentissage clinique, c’est un réel problème ! Quand on voit la différence de prix c’est dommage !
— Lamelyn Quentin (@QuentinLamelyn) 19 avril 2019
On devrait standardiser les noms partout en Europe et ne garder que comme première partie du nom la molécule. Par exemple, Esomeprazole-Nexiam; Pantoprazole-Pantomed. Ça éviterait de devoir tout réapprendre une fois que tu passes dans un pays limitrophe... #duvecu
— Jerome R. Lechien, MD, PhD, MS (@JeromeLechien) 20 avril 2019
Pas dans toutes les universités... adaptation du curriculum est primordialau realite du terrain.
— Sam Ward (@dr_wardsam) 20 avril 2019
Très bel article décrivant la situation. Deux remarques globales :
— Gilbert Bejjani (@drbejj) 20 avril 2019
1- quoique soit le secteur, il faut créer le cadre pour que des économies dégagées soient réinvesties ds le secteur
2- le marché de certains bioS est moins fragmenté que d’autres et l’incentive financier concntré
Au sujet du 1er point: je préfère en effet le concept des « shared savings » où patients, médecins, autres prof. de santé soient positivement impliqués. Mais il est urgent d’agir pour #biosimilaires
— Joris Van Assche (@AsscheJoris) 20 avril 2019
L’Europe et ses pays sont à la traîne au niveau Pharma. Harmonisation des noms... Mais aussi des prix, des règles d’accès, des conditions etc. Et sans parler de la recherche commune. Il n’est pas permis que certains médicaments soient si chers avec un marché si grand.
— Gilbert Bejjani (@drbejj) 20 avril 2019